[칼럼] 수능 화학2 칼럼 Part 2
안녕하세요! 지난 Part 1에 이어서 Part 2 작성해보도록 하겠습니다...! 글에 대한 설명은 Part 1 참고해주시길 바랍니다ㅎㅎ
5. 반응 엔탈피 (난이도: 3/10)
○ 핵심 개념: 여러 가지 반응 엔탈피 (생성 엔탈피 등), 결합 에너지와 반응 엔탈피, 헤스 법칙
액체, 고체 파트와 더불어 화학2에서 가장 쉬운 편에 속하는 반응 엔탈피 파트입니다. 엔탈피가 무엇인지를 토대로 화학 반응과 엔탈피 변화 간의 관계 정도만 이해하고 나면, 위에 핵심 개념이라고 나열한 것들을 어렵지 않게 학습할 수 있습니다. 그렇게 개념 학습이 끝나면, 문제를 푸는 것은 사실상 '단순 사칙연산'에 불과합니다. 아래 항목에서 설명드릴 예정이니, 중요한 개념들만 살펴보고 넘어가겠습니다.
- 반응열: 화학 반응이 일어날 때 방출하거나 흡수나는 열
- 엔탈피 (H): 특정 온도와 압력에서 어떤 물질이 가지는 고유한 에너지
- 반응 엔탈피 (△H): 생성물의 엔탈피 합 - 반응물의 엔탈피 합
- 발(흡)열 반응: △H가 0보다 작은(큰) 반응, 주위의 온도가 높아짐(낮아짐)
- 열화학 반응식: 화학 반응식과 반응 엔탈피를 함께 나타낸 식
- 생성 엔탈피: 어떤 물질 1mol이 성분 원소의 가장 안정한 원소로부터 생성될 때의 반응 엔탈피 (특별히 25°C, 1atm에서의 생성 엔탈피를 표준 생성 엔탈피라고 함)
- 분해 엔탈피: 어떤 물질 1mol이 가장 안정한 성분 원소로 분해될 때의 반응 엔탈피, 분해 엔탈피+생성 엔탈피=0
- 연소 엔탈피: 어떤 물질 1mol이 완전 연소하여 가장 안정한 생성물이 될 때의 반응 엔탈피, 항상 음(-)의 값
- 중화 엔탈피: 산의 수소 이온 1mol과 염기의 수산화 이온 1mol이 중화 반응하여 1mol의 액체 물이 생성될 때의 반응 엔탈피, 산&염기의 종류에 관계없이 일정
- 용해 엔탈피: 어떤 물질 1mol이 다량의 용매에 용해될 때의 반응 엔탈피
- 결합 에너지: 기체 상태의 물질을 구성하는 두 원자 사이의 공유 결합 1mol을 끊어 기체 상태의 원자로 만드는 데 필요한 에너지, 항상 양(+)의 값
- 헤스 법칙: 화학 반응이 일어나는 동안에 반응물의 종류와 상태, 생성물의 종류와 상태가 같으면 반응 경로에 관계없이 반응 엔탈피의 총합은 일정
- 반응 엔탈피(△H) = (반응물의 결합 에너지 합) - (생성물의 결합 에너지 합) = (생성물의 생성 엔탈피 합) - (반응물의 생성 엔탈피 합)
○ 대표적인 비킬러/준킬러 출제 내용: 결합 에너지와 반응 엔탈피 간의 관계 또는 헤스 법칙의 활용
이 파트에서는 주로 여러 가지 반응 엔탈피의 개념을 알고 있는지, 그리고 위에서 서술한 핵심 개념 중 마지막 줄의 식을 이해하고 잘 활용할 수 있는지를 묻는 문제가 출제됩니다. 그렇기 때문에 유효숫자가 3~5개 정도인 수치들의 덧셈과 뺄셈, 그리고 해당 수치들에 한 자리 자연수를 곱하는 과정의 결합이 이 파트 문제 풀이의 핵심이라고 할 수 있겠네요. 문제 자체의 난이도는 낮은 편에 속하지만, 계산에서 실수가 자주 발생하는 파트인 만큼 항상 신경 써서 계산하도록 합시다. 그럼 2022학년도 수능의 5번과 7번 문항만 간단히 풀어보겠습니다.
ㄱ, ㄴ, ㄷ 선지를 보면 각각 열화학 반응식에 대한 이해, 생성 엔탈피 개념에 대한 이해, 헤스 법칙의 이해를 묻고 있습니다. 반응식의 갯수가 많으면 노란색 동그라미와 같이, 엔탈피 도표를 그리는 것이 전체적인 상황에 대한 이해에 큰 도움이 됩니다. 그다지 어렵지 않은 내용인 만큼, 설명은 생략하겠습니다.


2022학년도 수능 화학2 5번 문항
반응 엔탈피와 결합 에너지 간의 관계, 헤스 법칙의 이해와 활용이 요구되는 전형적인 반응 엔탈피 파트 출제 문항입니다. 2021학년도 수능도 그렇고, 계산 과정에서 숫자가 은근히 깔끔하게 떨어지도록 출제하는 경향인 것 같습니다. 평가원에서 화학2를 선택하신 여러분이 너무 복잡한 계산을 하지 않도록 이렇게 배려해주는데 (사실 22년 9평 20번을 보면...크흠), 이 파트는 확실히 맞히고 넘어갑시다. 풀이 과정은 아래 그림에 표시된 내용이면 충분할 것이라 생각합니다.


2022학년도 수능 화학2 7번 문항
6. 화학 평형과 평형 이동 (난이도: 10/10)
○ 핵심 개념: 평형 상수(K)와 반응 지수(Q), 르샤틀리에 원리, 상평형
많은 화학2 선택자들을 좌절시키는 대망의 평형 파트입니다. 개념만 보면 별로 어렵지 않다고 생각할 수 있지만, 기체 파트와 맞물려 다채롭게 출제된 킬러 문제들을 보면 그 생각을 바로 수정하게 되죠. 킬러 문제와 준킬러 문제를 본격적으로 풀이해보기 전에, 꼭 알아야만 한다고 생각하는 개념들만 짚어보겠습니다.
먼저 화학 평형의 개념에 대해 알아야 할 텐데, 이를 위해서는 가역 반응이 무엇인지를 알아야 합니다. 가역 반응이란 반응 조건에 따라 정반응과 역반응이 모두 일어날 수 있는 반응을 의미하며, 화학 반응식에서 양쪽 화살표로 나타냅니다. 이에 반해 비가역 반응은 역반응이 정반응에 비해 무시할 수 있을 만큼 거의 일어나지 않아, 한쪽 방향으로만 진행된다고 취급하는 반응을 의미하며, 화학 반응식에서 ->로 나타냅니다. 그리고 화학 평형 상태란, 가역 반응에서 반응물과 생성물의 농도가 변하지 않아서 겉으로 보기에 반응이 정지된 것처럼 보이는 동적 평형 상태를 의미합니다. 이 파트에서는 평형 상태에 도달할 수 있는 가역 반응을 주로 다루고, 뒤에서 나올 반응 속도 파트에서는 비가역 반응을 주로 다룹니다.
그리고 일정한 온도에서 어떤 가역 반응이 화학 평형 상태에 있을 때, 반응물의 농도 곱에 대한 생성물의 농도 곱의 비가 항상 일정한데, 이 값을 평형 상수(K)라고 합니다. 즉, 아래와 같은 식으로 나타낼 수 있죠. 이때 주의할 점은, 고체 물질이나 용매는 평형 상수식에 나타내지 않는다는 것과 여러 개의 화학 반응식을 더할 때 평형 상수는 곱해진다는 것, 그리고 평형 상수는 온도에만 의존하는 값이라는 것 정도가 있겠네요.

2022학년도 수능특강 화학2 99p
이렇게 정의되는 평형 상수와 관련해서, 반응의 진행 방향 예측을 위해 도입한 값이 바로 반응 지수(Q), 평형 상수식에 반응물과 생성물의 현재 농도를 대입하여 구한 값입니다. Q가 K보다 작은 경우 (Q<K) 정반응 쪽으로 우세하게 반응이 진행되고, Q가 K보다 큰 경우 (Q>K) 역반응 쪽으로 우세하게 반응이 진행됩니다.
다음으로 르샤틀리에 원리 (평형 이동 법칙)이란, 화학 평형 상태에 있는 화학 반응에서 농도, 온도, 압력 등의 반응 조건을 변화시키면, 그 변화를 상쇄하려는 방향으로 반응이 우세하게 진행되어 새로운 평형에 도달하게 된다는 법칙입니다. '그 변화를 상쇄하려는 방향'에서 뭔가 물1에서 다뤘던 '패러데이 법칙'이 떠오르지 않나요? 그만큼 '자연은 변화를 싫어한다.'고 rough하게 생각해볼 수도 있겠네요. 농도나 압력의 변화에 의해 평형 이동이 일어날 때에는 평형 상수가 변하지 않고, 온도의 변화에 의해 평형이 이동하면 평형 상수가 달라진다는 점은 평형 상수의 정의와 관련지어 이해하면 됩니다. 각각의 요인의 변화에 따라 평형 이동이 어떻게 일어나는지는 아래의 도식으로 정리할 수 있습니다.
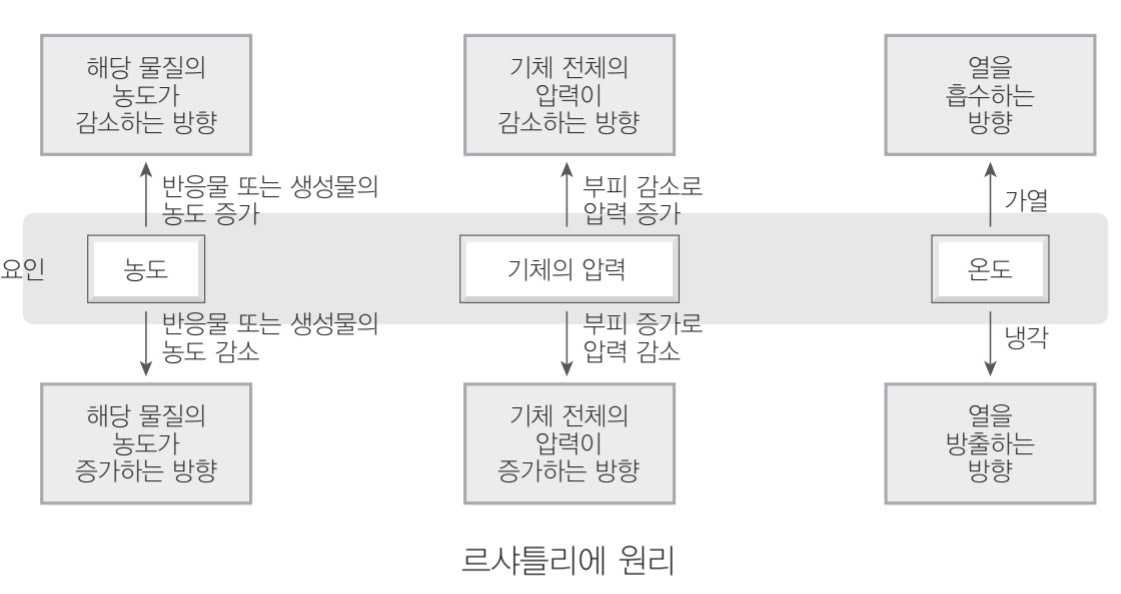

2022학년도 수능특강 화학2 106p
마지막으로 다룰 상평형은 어떤 계가 열역학적으로 가장 안정한 상태에 도달하여 상 간의 이동이 더이상 일어나지 않는 평형 상태를 의미합니다. 화학2의 상평형에서는 하나의 물질에 대한 고체, 액체, 기체의 상태에 관해서만 다룹니다. 상평형에 관해서는 융해 곡선, 증기 압력 곡선, 승화 곡선, 삼중점이 각각 상평형 그림에서 어떤 것에 해당하고 무엇을 의미하는지, 물과 같이 융해 곡선의 기울기가 음의 값을 갖는 경우는 일반적인 이산화탄소와 같은 경우와 어떻게 다른지 정도를 알고 계시면 됩니다.
○ 대표적인 킬러 출제 내용: 기체와 평형 이동 (4페이지)
킬러가 출제되는 내용 자체는 위와 같이 짧게 요약할 수 있지만, 실제로 출제된 문제들을 보면 문제 상황이 정말 다양합니다. 평형 이동의 원인이 되는 요인의 변화가 압력이나 온도인 경우가 대부분인데, 압력의 변화는 꼭지의 개폐 여부, 피스톤의 고정 여부 등의 다양한 원인의 조합으로 일어나기 때문에 전반적인 상황이 복잡하게 느껴지는 경우가 많습니다. 그리고 아래에서 다룰 준킬러 문제들과 달리, 직접적인 평형 상수의 계산, 평형 상태에서의 기체 조성 구하기, PV=nRT의 적극적인 활용 등을 복합적으로 요구하는 경우가 많다는 특징이 있습니다. 교과 과정에서 직접 다루지 않는 '압력 평형 상수(평형 상수의 정의에서 기체의 몰농도 대신 부분 압력을 대입하여 구한 값)'의 개념을 활용하는 것이 문제 풀이에 유리한 경우도 있구요. 사실 일반화학 과정에서 기체에 관한 평형을 다룰 때, 대부분 압력 평형 상수를 사용하긴 합니다. 하지만 수험생의 입장에서 그것까지 자세히 알 필요는 없고, 평형 상수의 수치를 구하는 것이 아니라 다른 온도에서의 평형 상수를 비교할 때만 상황에 따라 적절히 사용하시면 됩니다.
구체적인 문제 상황에 따라 달라지겠지만, 혼합 기체의 압력이 일정한 경우에 압력 평형 상수를 이용하는 것이 편할 때가 많습니다. 만약 이를 우리가 알고 있는 평형 상수로 변환해야 한다면, 다음과 같은 관계식을 통해 변환이 가능합니다. R은 어차피 상수이기 때문에, 보통은 R=1으로 취급하여 계산하곤 합니다.
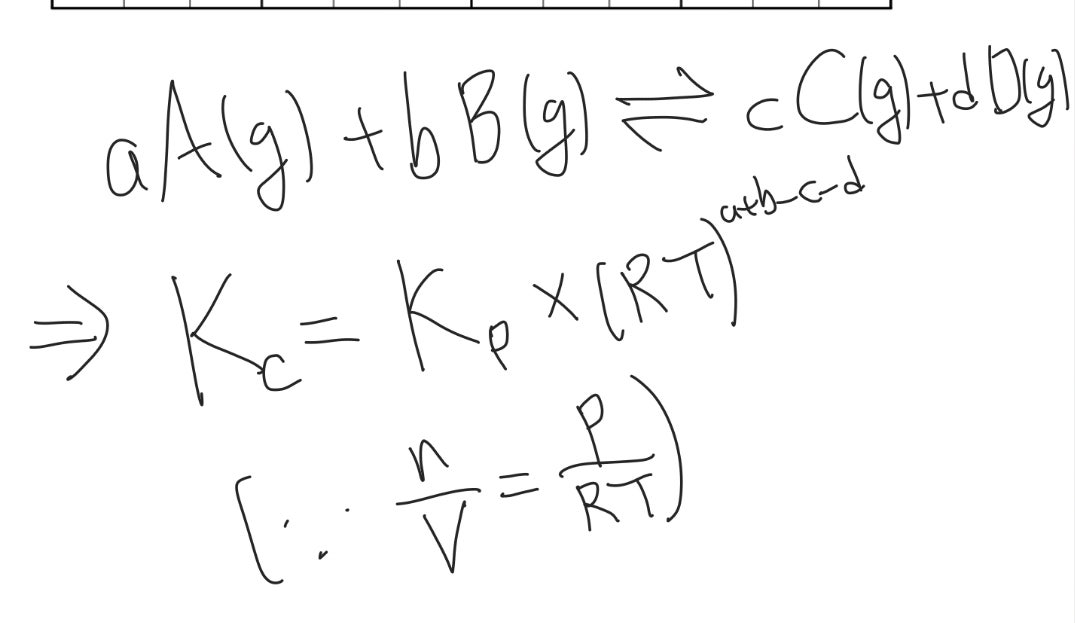

농도로 정의된 평형 상수와 압력으로 정의된 평형 상수 간의 관계식
보다 구체적인 내용은 2022 9평, 2021 수능에 출제된 킬러 문제들을 풀이하면서 설명드리겠습니다. 풀이에서 중요하다고 생각되는 부분에 밑줄을 쳤으니, 해당 부분을 중심으로 문제 풀이에 관해 얻어갈 점을 얻어가시면 됩니다! (※ 2022학년도 수능에서는 기존의 출제 경향과는 조금 다르게, 4페이지에 평형 파트의 킬러 문제가 출제되지 않았습니다. 대신 지난 글에서 설명 드렸던 신유형의 20번이 출제되었죠.)
먼저 2022학년도 9평의 20번 문항입니다. 문제 밑에 빈 공간이 넓었던 것이 문제의 난이도를 예고하는 것이 아니었을까라는 생각이 들 정도로, 풀이에 시간이 꽤 걸리는 어려운 문제라고 생각합니다. 다음으로 풀이할 21학년도 수능의 20번 문항과 더불어, 개인적으로 현장에서 풀었던 화2 문제 중에 가장 어려운 문제입니다.
각설하고 문제를 같이 봅시다. 실린더 (가)와 (나)의 초기 상태와 평형 상태에 관한 정보가 각각 그림과 표로 주어져 있습니다. 가장 먼저 해야 할 일은 기체 파트와 마찬가지로, 1)처럼 TK에서의 1atm*L를 N mol이라고 설정하는 것입니다. 1mol로 설정해도 문제 풀이에 지장은 없습니다. 1)과 같이 설정하면, (가)의 초기 상태는 C가 N mol, (나)의 초기 상태는 A와 C가 각각 N mol씩 있는 상황이라는 것을 파악할 수 있습니다.
그리고 표에서 TK과 5T/4 K에서 (나)의 평형 상태에 관한 정보를 바탕으로, 2)와 같이 평형 상태의 A, B, C의 몰수를 각각 구합니다. 혼합 기체가 실린더에 들어 있어 전체 압력이 1기압으로 유지되고, 그렇기 때문에 일정한 온도에서 혼합 기체의 부피가 혼합 기체의 몰수에 비례한다는 것을 활용했습니다. 이때, 5T/4 K에서는 1)에서 설정한 atm*L와 mol 간의 관계에 대해 온도 보정을 해주어야 합니다. 그렇게 A, B, C의 몰수를 모두 구하면, 각각의 평형 상수를 계산하여 문제에서 구하고자 하는 K_1과 K_2의 비를 구할 수 있습니다. 이때, 저는 혼합 기체의 압력이 1기압으로 일정하기 때문에, 압력 평형 상수를 구하고 온도에 대한 보정값을 곱해 농도 평형 상수를 구하는 방식을 택했습니다. 이에 대해서는 위에서 설명드린 바 있죠.
마지막으로 TK에서의 (가) 속 기체의 밀도를 구해야 하는데, 화학 반응이 일어나도 질량이 보존된다는 것을 고려하면 결국 (가)에서 평형에 도달했을 때 혼합 기체의 부피를 구하는 것이 문제에서 요구하는 바임을 알 수 있습니다. 계산의 편의를 위해 C가 2tN mol 반응해서 A와 B가 각각 2tN mol, tN mol 생성되었다고 가정하고 2)에서 구한 평형 상수와 비교하면 4)와 같이 식을 세울 수 있고, 삼차방정식(인 줄 알았지만 사실은 일차방정식)을 풀이하면 t=1/3을 얻어 혼합 기체의 부피가 4/3 L <=> 기체의 밀도가 0.75g/L임을 얻습니다. 따라서 3)의 결론과 4)의 결론을 곱해주면 1번 선지에 해당하는 값이 얻어집니다.


2022학년도 9평 화학2 20번 문항
다음으로는 2021학년도 수능의 20번 문항입니다. 이 문제는 위에서 풀이한 문제보다는 난이도가 낮다고 생각하지만, 압력 평형 상수의 활용이 노골적으로 유리하고 자료 해석 능력이 요구된다는 점에서 체감 난이도는 굉장히 높았던 기억이 있습니다.
먼저 파란색으로 표시된 부분의 자료 해석이 이뤄져야 합니다. A와 B의 화학식량 비, 그리고 B의 질량/전체 질량을 활용해 A와 B의 몰분율을 구할 수 있다는 점을 파악하지 못했다면, 그 다음 과정으로 나아가기가 정말 어려웠을 것입니다. 그리고 2)와 같이 (ㄴ)과 (ㄷ)의 상태에 대한 비교를 통해 P_1과 P_2 사이의 관계를 구해야 합니다. 이때, 온도가 같기 때문에 두 점에서의 평형 상수 역시 같다는 점을 떠올렸어야겠죠? 마지막으로는 3)과 같이 (ㄱ)과 (ㄴ)의 상태에 대한 비교를 통해 문제에서 요구하는 T_1과 T_2 사이의 관계를 구하면 되는데, 이때는 혼합 기체의 조성이 같다는 점을 활용할 수 있습니다. 자세히 말씀드리면, 초기 상태가 동일하고 A, B의 몰분율이 동일하기 때문에 혼합 기체의 몰수 역시 동일할 것입니다. 따라서 혼합 기체에 PV=nRT를 적용하여 3)과 같이 식을 세우고, 빨간색으로 표시한 부피 관계와 압력 관계를 대입하면 문제에서 요구하는 온도 관계를 구할 수 있습니다.
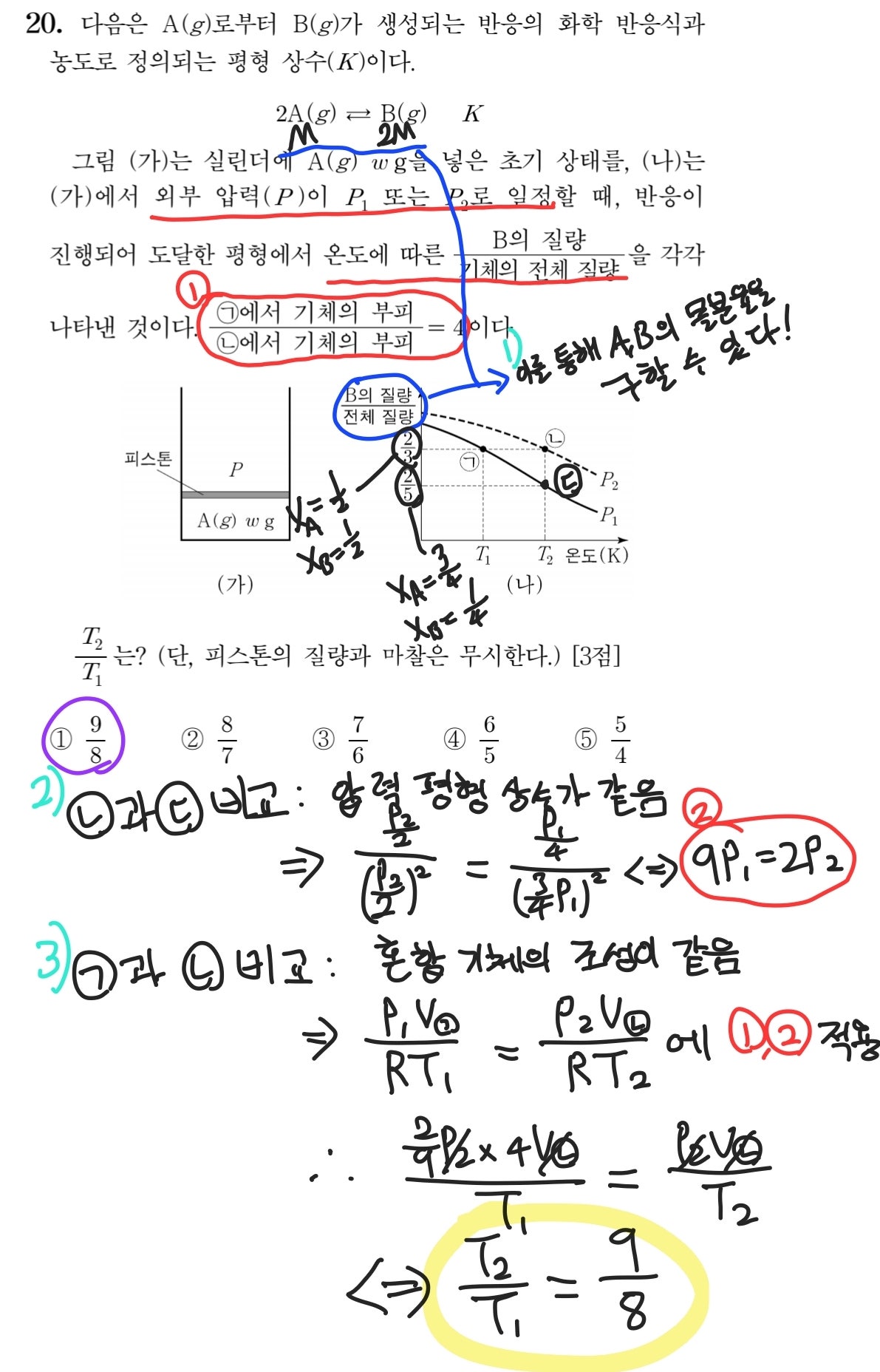

2021학년도 수능 화학2 20번 문항
○ 대표적인 준킬러 출제 내용: 기체와 평형 이동 (3페이지)
준킬러가 출제되는 내용도 위에서 설명드린 킬러 출제 내용과 거의 동일합니다. 다만 문제의 전반적인 복잡성과 계산의 난이도 등이 킬러 문제들에 비해 평이한 것뿐이죠. 바로 기출 문제들을 풀이하면서 킬러와 어떤 차이가 있는지 알아봅시다.
먼저 2022학년도 수능의 16번 문항입니다. 지금쯤이면 1)과 같은 설정에 익숙해졌으리라 믿습니다. 그러면 혼합 기체의 부피가 5/4 L임을 통해 2)와 같은 정보를 얻을 수 있고, 평형 상수 역시 구할 수 있겠네요. ㄱ 선지는 해결되었습니다. ㄴ 선지는 실린더 속 혼합 기체의 압력이 1기압으로 유지된다는 점을 알고 있는지 묻고 있습니다. 2)를 토대로 C의 몰분율을 구하면 옳다는 결론이 나옵니다. 마지막으로 ㄷ 선지는 반응 지수를 통한 반응 방향의 예측을 묻고 있습니다. 이때, 피스톤이 고정되었으므로 용기의 부피가 9/4 L로 일정하다는 점과 2)와 그림을 통해 알고 있는 A, B, C 각각의 몰수를 통해 반응 지수를 계산하면 평형 상수와 같은 값이 나와 ㄷ 선지가 틀렸음을 알 수 있습니다.
각각의 선지에 대한 정오 판단의 난이도가 위에서 다룬 킬러 문제들에 비해 확연히 낮고, 자료 해석 역시 비교적 단순함을 알 수 있습니다. 만약 화학2의 평형 파트를 처음 공부하는 수험생이라면, 3페이지에 출제되는 정도의 준킬러 문제들을 정확하고 빠르게 풀이할 수 있는 정도의 실력을 갖춘 후에, 4페이지에 출제되는 정도의 킬러 문제 정복에 도전할 것을 추천합니다.

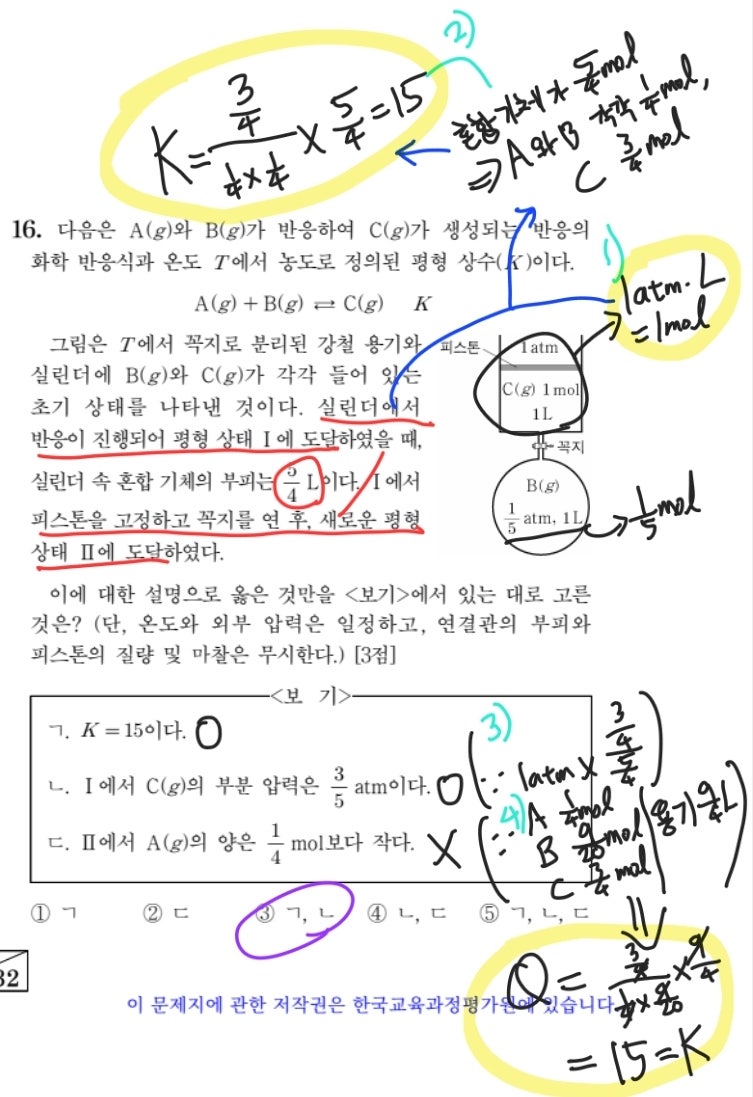 2022학년도 수능 화학2 16번 문항
2022학년도 수능 화학2 16번 문항다음으로는 2022학년도 9평의 16번 문항입니다. 그림에서 (나) 부분의 정보를 통해, 1)과 같이 설정하는 것이 첫번째 해야 할 일입니다. 그리고 K=1과 (가) 그림의 정보를 통해, 2)와 같이 평형 상태 1에서의 혼합 기체의 조성을 어렵지 않게 구할 수 있습니다. 정석적으로 풀이한다면 생성된 C의 양을 t mol이라고 놓고 방정식을 세워야겠지만, 화2를 선택하신 여러분이라면 이 정도로 간단한 상황에서는 바로 A, B, C의 양을 구할 수 있어야 합니다. 지금까지의 과정을 통해 ㄱ 선지와 ㄴ 선지에 대한 정오 판단이 가능하겠네요. 마지막으로 꼭지를 연 순간에 대해 반응 지수를 구해 평형 상수와 비교함으로써, 역반응이 우세하게 진행되어 평형 상태 2에 도달한다는 것을 알 수 있고, 역반응은 기체 분자 수가 증가하는 반응이기 때문에 ㄷ 선지는 옳습니다. 3페이지에 있지만 2점짜리 문항인 만큼, 어렵지 않게 풀이할 수 있어야 합니다.
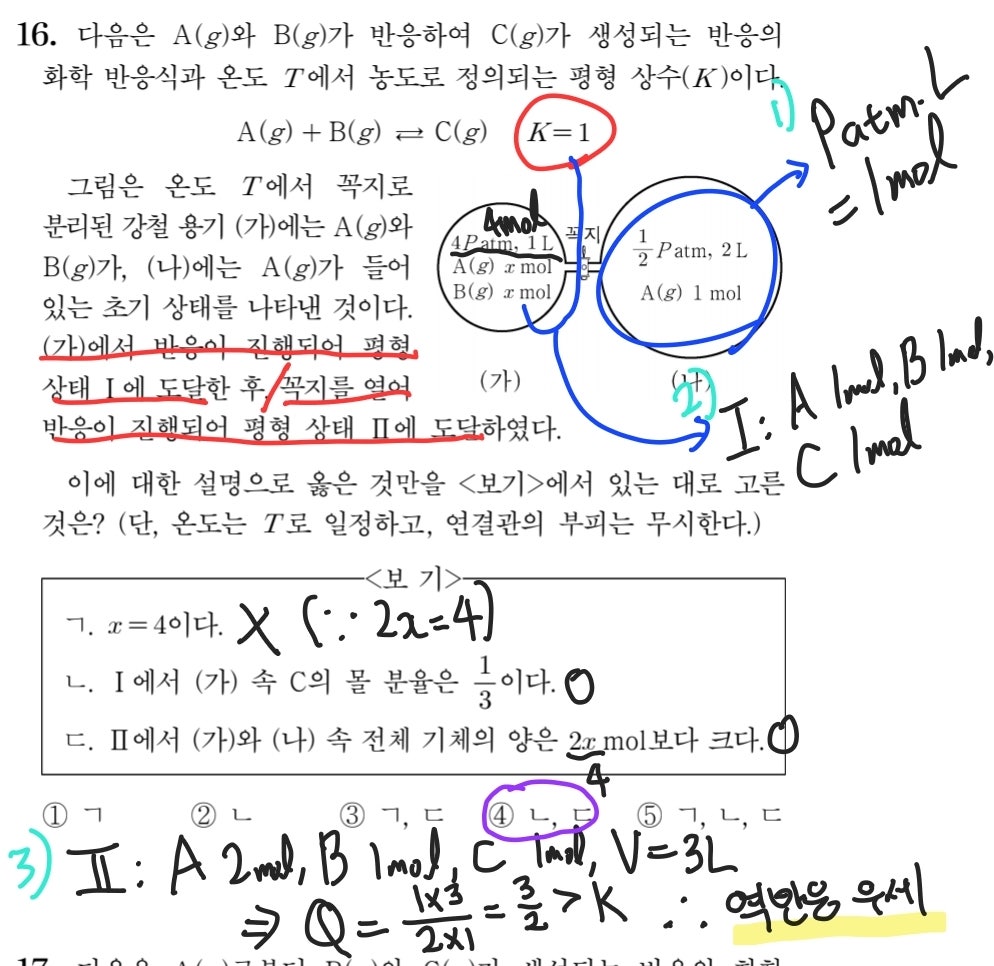

2022학년도 9평 화학2 16번 문항
마지막으로 2021학년도 수능의 17번 문항입니다. 이 문제는 위에서 풀이한 2022학년도 수능 16번 문항과 굉장히 유사한데, A의 상태가 고체라는 점만 잘 확인하면 큰 어려움 없이 문제를 해결할 수 있습니다. 당연히 고체는 평형 상수 식에 포함 안 되는 것 다들 알고 계셔야 합니다...! 문제 풀이는 하늘색으로 번호 매긴 순서대로 따라가시면 되고, 글로 따로 설명하지 않아도 될 것 같아 생략하겠습니다.
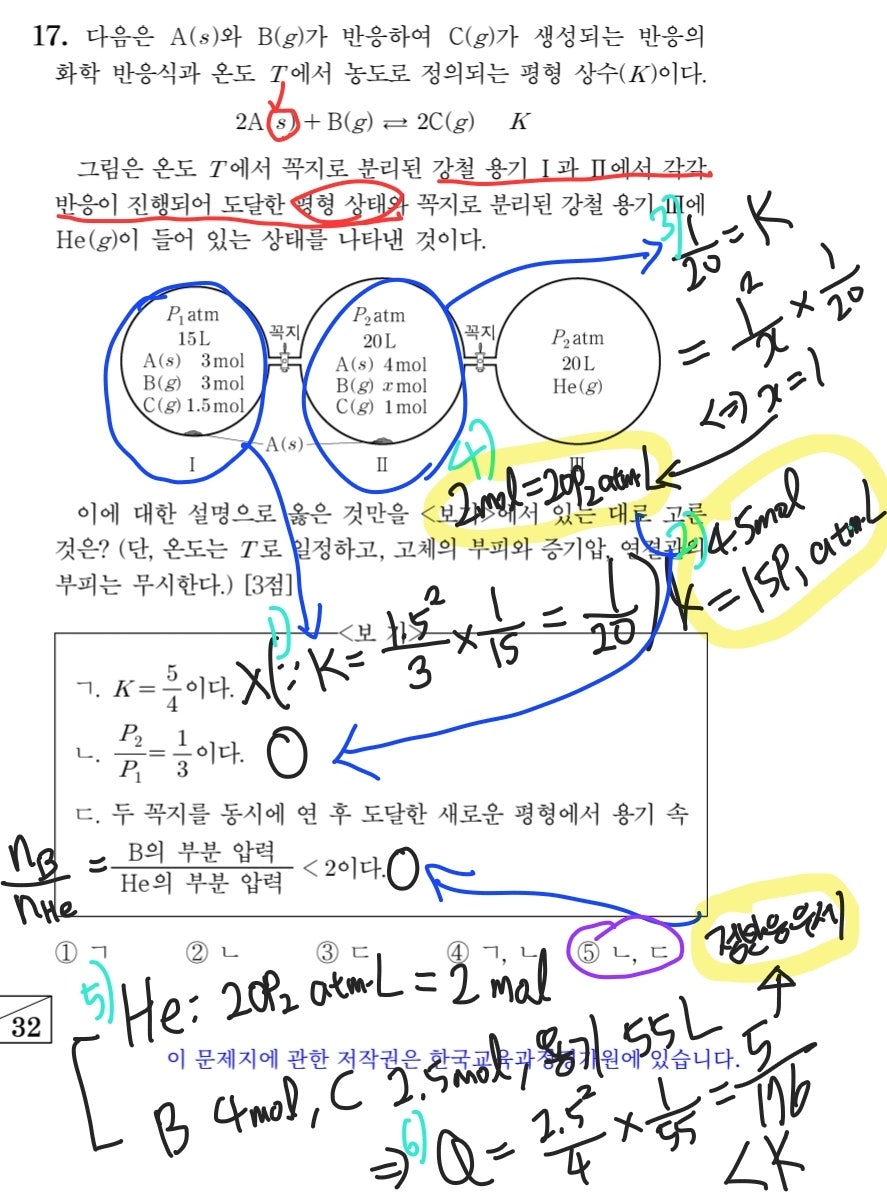

2021학년도 수능 화학2 17번 문항
○ 대표적인 비킬러 출제 내용: 상평형
같은 평형 파트에 속하지만, 위에서 길게 다뤘던 기체와 화학 평형의 이동에 관한 문제에 비해 훨씬 쉽게 느껴지는 상평형 관련 문제도 매 시험마다 1~2페이지에 1개 정도씩은 꼭 출제되는 것 같습니다. 이 파트는 위의 핵심 개념에서 밑줄 그은 부분 정도만 정확히 이해하고 있으면 어렵지 않게 해결할 수 있습니다. 2022학년도 수능에 마땅한 문제가 없어, 2022학년도 9평의 6번 문항만 풀어보고 넘어가겠습니다.
상평형에 관해서 출제될 수 있는 대표적인 유형의 문제로, 끓는점, 녹는점, 삼중점 등에 관한 정보를 글로 제공하여 이를 바탕으로 상평형 그림을 그릴 수 있는지의 여부를 묻는 문제입니다. 상평형 그림에서 삼중점은 융해 곡선과 증기압력 곡선, 승화 곡선의 교점에 해당하기 때문에 P-T 그래프에서 끓는점이나 녹는점보다는 항상 아래에 위치합니다. 그리고 녹는점과 삼중점의 T를 비교하여 융해 곡선의 기울기 부호를 판단할 수 있구요. 이를 바탕으로 상평형 그림을 그리면 아래와 같고, 이 그래프를 보며 각각의 선지에 대한 정오를 판단하시면 문제는 해결됩니다.


2022학년도 9평 화학2 6번 문항
7. 산 염기 평형 (난이도: 7/10)
○ 핵심 개념: 산과 염기의 세기 비교, 이온화도와 이온화 상수, 짝산-짝염기, 염의 가수분해, 완충 용액
교육 과정이 개정되면서 중화 적정 등의 내용이 빠지면서 절대적인 개념의 양 자체는 적은 편이지만, 개념 자체의 난이도가 높고 이온화도와 이온화 상수를 활용한 다양한 상황에서의 계산 등으로 인해 출제될 수 있는 문제의 난이도가 무궁무진하다는 점에서 이 파트에 높은 난이도를 부여했습니다. 이 파트에서 꼭 알고 넘어가야 할 개념들에 대해서 알아볼텐데, 염기의 경우에는 대부분 산과 동일한 방식으로 정의 및 설명될 수 있기 때문에 산에 대해서만 설명하도록 하겠습니다.
우선 화학2에서 주로 사용하는 산과 염기의 정의는 브뢴스테드-로리의 것입니다. 즉, 산은 수소 이온을 내놓는 물질, 염기는 수소 이온을 받아들이는 물질로 정의되죠. 그리고 2022학년도 수능특강에 따르면, 물에 녹아 대부분 이온화하는 산을 강산, 물에 녹아 일부만 이온화하는 산을 약산이라고 정의합니다. 참 애매한 정의이지 않나요? '대부분'과 '일부만'이 대체 어느 정도인지를 알 수가 없으니 말이죠. 그래서 친절하게도 대부분의 문제에서는 산의 절대적인 세기를 묻지 않고, 여러 산의 상대적인 세기 비교에 관해 묻습니다. 그러한 산의 세기 비교를 다루기 위해 필요한 몇몇 개념부터 짚어 보겠습니다. 짝산과 짝염기는 수소 이온의 이동에 의해 산과 염기로 되는 1쌍의 산과 염기로 정의되며, 이온화도와 이온화 상수의 정의, 짝산과 짝염기의 관계는 다음과 같이 서술할 수 있습니다.


이러한 정의 및 관계 등을 토대로, 이온화 상수가 클수록 상대적으로 강한 산이고, 산의 세기가 강할수록 그 짝염기의 세기는 약하다는 점을 파악할 수 있고, 이를 통해 산의 상대적인 세기 비교가 가능합니다.
그리고 산의 음이온과 염기의 양이온이 결합하여 생성된 이온 결합 물질을 '염'이라고 정의하며, 염의 수용액에서 염을 이루는 이온이 물과 반응하여 하이드로늄 이온(H3O+)이나 수산화 이온(OH-)을 생성하는 반응을 '염의 가수 분해'라고 정의합니다. 이때 산과 염기의 세기에 따른 산의 음이온 또는 염기의 양이온의 가수 분해 여부에 따라 염 수용액의 액성이 달라지게 되는데, '강산+강염기: 중성, 강산+약염기: 산성, 약산+강염기: 염기성' 정도만 기억하시면 됩니다. 약산과 약염기의 반응으로 생성된 염은 약산과 약염기의 상대적인 세기에 따라 그 액성이 달라지는데, 화학2에서는 따로 다루지 않습니다.
마지막으로 완충 용액은 약산과 그 약산의 짝염기, 또는 약염기와 그 약염기의 짝산이 섞여 있어 산이나 염기를 소량 가해도 pH가 거의 변하지 않는 수용액으로 정의됩니다. 여기서 pH는 pH=-log [H3O+]의 식으로 정의되며, 25°C에서 K_w=10^(-14)임과 물의 자동 이온화 반응을 고려했을 때 일반적으로 pH=7을 중성, pH>7을 염기성, pH<7을 산성이라고 이야기합니다. 그리고 일반적으로 약산과 짝염기의 몰수가 같은 값에 가까울수록, 그리고 그 몰수가 클수록 좋은 완충 용액이라고 한다는 점은 상식으로 알아두면 좋을 것 같습니다.
추가적으로, 약산의 이온화도와 이온화 상수의 관계에 관해 다음과 같은 식들을 알아두면 문제를 풀이할 때 큰 도움이 되니 꼭 이해 및 암기하도록 합시다.


○ 대표적인 준킬러/비킬러 출제 내용: 산 또는 염기의 이온화 평형에 관한 여러 계산 / 완충 용액에 대한 이해
다행스럽게도 아직까지는 평가원에서 사설과 같은 4페이지 킬러 수준의 고난도 산 염기 문제를 출제하지는 않고 있습니다. 하지만 점점 고여 가는 수능 판의 특성으로 인해, 수험생 간의 변별을 위해 고난도 문제가 출제될 가능성이 항상 존재하는 파트라는 점을 잊지 않으시길 바랍니다. (사설에서 고난도 산 염기 문제라고 거르지 말고 풀어야 한다는 뜻입니다!) 그럼 준킬러 출제 내용에 관해 3문제, 비킬러 출제 내용에 관해 1문제를 풀어보면서 이번 글을 마무리하도록 하겠습니다.
먼저 2022학년도 수능의 15번 문항입니다. 약산의 이온화 평형에 관해 묻는 전형적인 문제인데, (가)에 관해 주어진 정보를 통해 이온화도의 값과 이온화 상수의 값을 구하는 것이 첫번째로 할 일입니다. 이에 의해, ㄱ 선지는 거짓입니다. 그리고 이온화 상수의 정의에 (나)의 수소 이온 농도를 대입하면, ㄴ 선지가 참임을 쉽게 알 수 있습니다. 마지막으로 ㄷ의 상황은 중화 적정에서 당량점에 도달한 상황이므로, 0.3M의 A- 수용액이 있는 상황으로 취급할 수 있습니다. 따라서, 위에서 다룬 여러 식들을 활용하면 최종적으로 pH의 값이 9+log3으로 얻어지므로, ㄷ 선지는 참입니다.
밑줄 친 부분처럼, 산과 염기의 중화 반응이 일어날 때에는 중화 적정의 당량점을 기준으로 상황을 판단하는 것이 편할 때가 많습니다. 대표적인 예를 들면, 15번 문제와 같은 상황에서 [HA]=[A-]이면 중화 적정에서 당량점의 50%에 해당하는 상태라고 이야기하죠. 이에 대해서는 어나클에서 자세히 다루었던 걸로 기억하니, 더 많이 알고 싶은 분들께서는 어나클이나 기타 시중 교재, 책을 사기 싫다면 나무위키 등을 참고하시길 바랍니다!


2022학년도 수능 화학2 15번 문항
다음으로는 2022학년도 9평의 14번 문항입니다. (가)의 평형 상태에 대한 정보에서 [HB]=[B-]임을 통해 당량점의 절반에 도달한 상황이라는 것을 알 수 있고, 이를 통해 x의 값을 구할 수 있습니다. 또, 헨더슨-하셀바흐 식을 통해 HB의 이온화 상수까지 구할 수 있겠네요. 이제 발문에서 제시된 식을 통해 HA의 이온화 상수를 구할 수 있고, (나)의 혼합 조건을 보면 당량점에 해당하는 상황임을 알 수 있습니다. 따라서 0.1M A- 수용액과 같은 상황으로 취급할 수 있고, 구체적인 계산을 위해 짝산과 짝염기의 관계를 활용해 A-의 이온화 상수까지 구합니다. 그리고 이온화 상수와 이온화도 (여기선 1/y겠죠?)의 관계식을 활용해 y를 구하면 문제 풀이가 끝납니다. 앞에서 말씀드린 중화 적정의 당량점을 기준으로 상황을 판단하는 방법이 두 번이나 사용되었네요. 잘 알아둡시다.
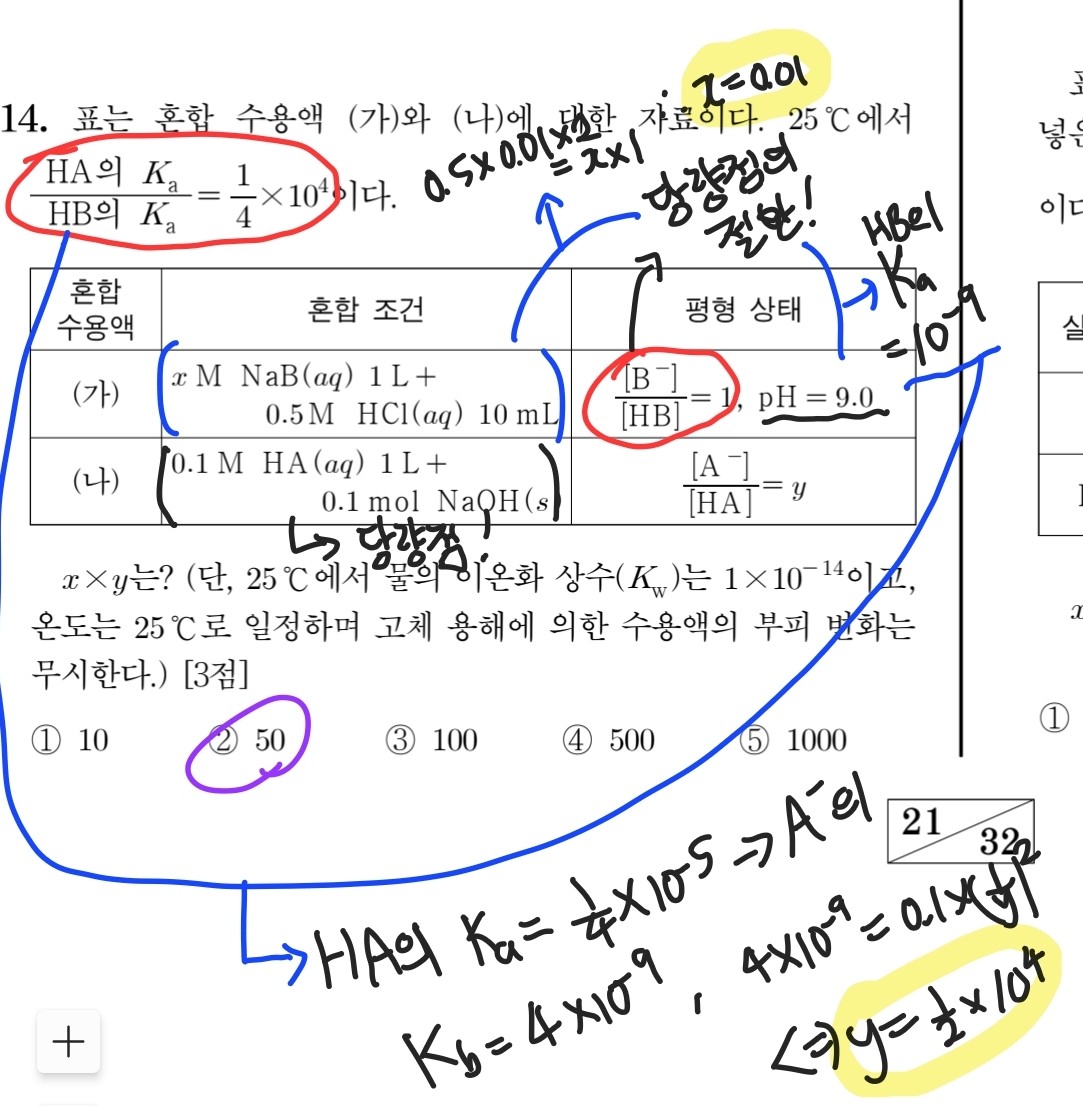

2022학년도 9평 화학2 14번 문항
그래프 해석 능력이 요구되었던 2021학년도 수능의 13번 문항도 풀어보겠습니다. 막상 풀어보니 준킬러라 하기에는 쉬운 편에 속하는 문제네요. 앞에서 말씀드린 바와 같이, 주어진 그래프에서 x좌표와 y좌표의 곱이 약산 HA, HB 각각의 이온화 상수가 된다는 점만 파악하면 ㄱ 선지와 ㄴ 선지가 바로 해결됩니다. 그리고 ㄱ 선지에서 HB의 이온화 상수를 아는 상황에서, 초기 농도가 0.1M일 때 [H3O+]를 구하는 ㄷ 선지는 이온화도와 이온화 상수 간의 관계식을 통해 어렵지 않게 정오를 판단할 수 있습니다. 그런데 이 문제의 HB와 같이 <0.1M 약산, 이온화 상수=1X10^(-5)>의 조합으로 출제되는 문제들이 정말 많아서, 해당 정보를 접하면 초기 pH, 당량점에서의 pH 등의 정보가 바로 기억이 날 정도는 되어야 화학2 문제 좀 풀어봤다고 할 수 있다고 생각합니다.
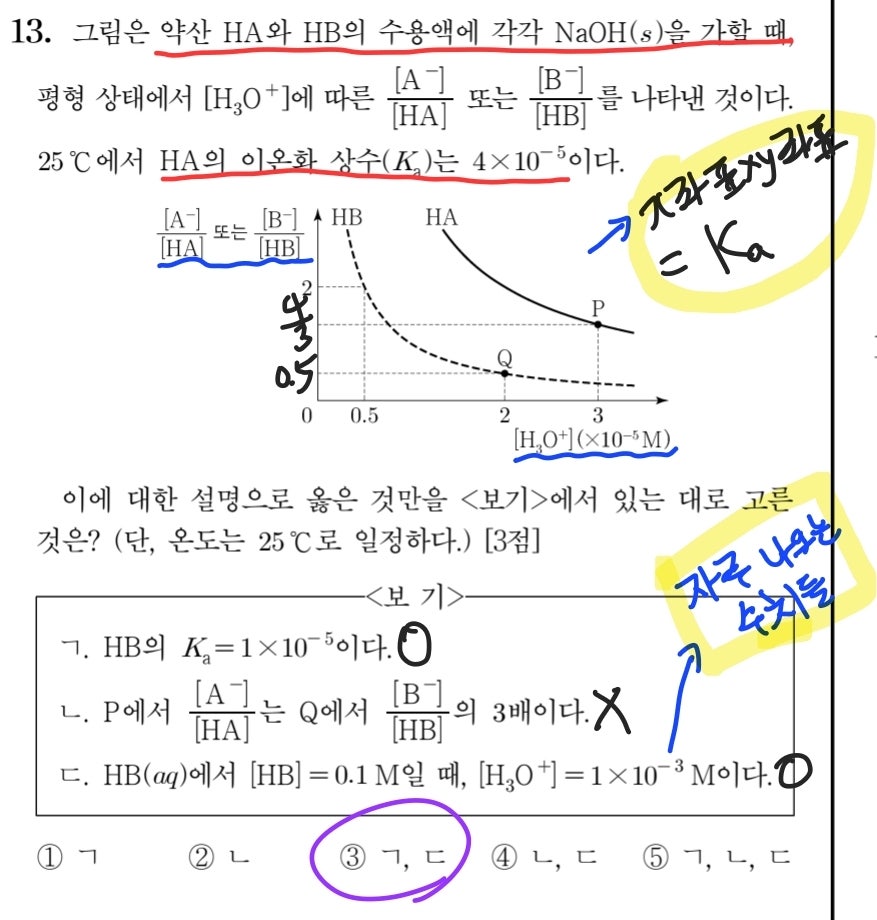

2021학년도 수능 화학2 13번 문항
마지막으로 풀어볼 문제는 2022 수능의 11번 문항입니다. 빨간 줄로 표시한 부분을 읽고 바로 완충 용액을 떠올렸어야 합니다. 이후 각 선지를 판단하는 것은 이온화 상수의 정의, pH의 정의, 르샤틀리에 원리 정도를 활용하면 어렵지 않게 가능합니다. 완충 용액에 관해서는 이 문제 정도의 난이도로 어렵지 않게 묻는 경우가 많으니, 개념만 확실하게 알아둡시다.


2022학년도 수능 화학2 11번 문항
평형 파트는 확실히 글을 작성하는 데 시간이 많이 필요하네요... 다음에 다룰 반응 속도 파트도 벌써부터 걱정이 됩니다ㅋㅋㅋ 아무쪼록 화2 선택자 분들께 조금이나마 도움이 되길 바랍니다...!
0 XDK (+11,000)
-

10,000
-


1,000
-
컴터로만 해야하나..
-
메가 찐초록 8칸 뜨는데, 다른곳 안돌려도 되겠지? 1
고속성장도 8칸인데 진학머시기랑 유웨이 안돌려도 되는거겠죠?
-
http://news.naver.com/main/read.nhn?mode=LSD&mi...
-
나 잠 좀 자고 싶다...
-
유웨이는 0
ㅈㅎㅅ는 그렇다치고 지금 유웨이는 정학한간가여 그럼 ㅠ?
















배부른에서 먼저 봤는데 너무 좋은 칼럼이네요 ㅎㅎ
감사합니다ㅎㅎ
물1 비역학이랑 화학2 칼럼 너무 잘읽었어요 감사합니다!
물1 준킬러 칼럼도 곧 올라올까요~?
역학 파트 말씀하시는 거라면, 아직 작성 시작 안 했고 공강 때 틈틈이 쓰는 거라 시간이 좀 걸릴 것 같아요..!

화2 . . . 역시 어지럽네요재밌는 과목입니다ㅎㅎ
파트3 존버중입니다...