논리화학의 최단경로 [2]
개강 전까진 1주 2회(화/토 연재)로 바꿈.
개강후엔 쓰고싶을때 쓸듯
칼럼의 컨셉은 저번에도 말했듯이 '최단경로'임
'합리적이고 일관적이며 빠른' 풀이가 아니라 '최단경로'가 컨셉임을 유의하면 좋겠음
풀이가 좀 너무 발상적이라던가 내분을 너무 쓴다거나 그런 느낌이 들 수 있긴 할거임.
실제로도 시험장에서 모든 문제를 최단경로로 풀려고 하면 오히려 꼬이게 됨
그래도 적어도 기출문제에 한해선 최단경로 풀이를 혼자 생각해보고 알아두면 좋다고 생각해서 쓰기 시작한 칼럼임
칼럼 읽는 방법
1. 문제 사진을 보고 혼자 최단경로 풀이를 생각해본다
(혼자 안 풀어보고 풀이 감상만 하면 도움은 1도 안되고 오히려 독이 됩니다)
2. 자신의 풀이와 칼럼의 풀이를 비교 해 보고 자기가 더 빠르면 댓글로 단다
3. 혹시 최단경로 풀이를 보고 싶은 기출문제는 문항넘버나 문제 캡처한 사진을 댓글로 단다
여기서 최단경로 풀이는 답을 맞추는게 아닌 증명을 의미함
예를 들어 문제에서 케이스가 두 개면, 반대편 케이스가 틀렸다는 증명도 풀이에 들어가야함
그러니깐 잘찍어서 푸는 풀이로 풀어놓고 댓글다는 이상한 짓은 ㄴㄴ
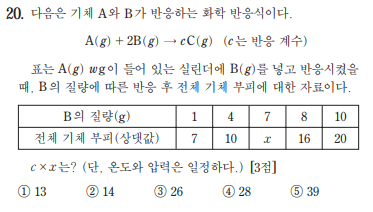
오늘은 양적 3개, 중화 1개를 준비해옴
오늘 양적은 일차함수 그래프 유형을 컨셉으로 잡았음
비킬러는 선별하기가 애매해서 댓글로 원하는거 달아주면 그거 해 드릴게요

161120
스포방지용 간격
최단풀이
1. B의 질량 (1~4), (4~8), (8~10) 각각의 변화량은 3, 6, 4이고 기울기는 1, 1.5, 2임. 투입유형의 성질을 생각하면 기울기가 3개가 나오려면 (4~8)구간에 완결점이 존재함.
2. 기울기가 1, 1.5, 2 이므로 기울기를 내분 해 주면 완결점은 6(4와 8의 중점)일때임
3. 완결점 이후에 그래프 공식은 투입한 B의 질량을 t로 두면 y=2t이고, x(B질량 7)는 완결점 이후이므로 x=14
4. 기울기 공식 (c-a)/b를 사용하면 (c-1)/2:1=1:2에서 c=2. 답 28
마지막 c 구하기 다른 방법 : 완결점 이전 일차함수 공식은 y=t+6임
t=0일때 y=6, 완결점인 t=6일때 y=12이므로 전체 기체 부피 2배 -> a:c=1:2에서 c=2
추가설명
나머지는 스킵하고
기울기 내분 사용법 : 밀도 내분하듯이 기울기를 내분하면 됨
위 문제에선 기울기 1이랑 2를 걸친 평균 변화율이 1.5였으므로 1:1내분한것
물리 예시) 1차원 상의 어떤 물체가 4m/s로 운동하다가 10m/s로 속력을 바꿔 운동했는데, 평균속도가 8m/s이다. 총 운동시간이 6초라면, 4m/s로 운동한 시간은?
풀이 : 8의 4와 10에 대한 내분비는 2:1임. 따라서 시간 비는 역수이므로 1:2, 4m/s로 운동한 시간은 2초

190919
스포방지용 간격
이건 최단루트를 완벽히 이해하면 암산까지 가능한데, 대신에 중간중간 생각할게 좀 있고 일반적인 풀이 같지는 않음
최단루트
1. 그래프의 기울기가 완결점 전후 -3:1이므로 기울기 공식에 의해 a=5를 얻음.
2. 초기 부피가 y이므로, 완결점(B 5w)에서의 부피는 계수 비에 의해 2y/5
3. 반응 계수비를 보면 B:C=1:2이므로 이때까지 투입한 B의 부피는 y/5이며, 이게 5w의 부피임을 알 수 있음. 즉 B w당 부피가 y/25
4. 따라서 B 8w지점에서 전체 기체 부피는 2y/5 + 3y/25 = 13y/25. 이게 26이므로 y=50
5. B w당 부피가 y/25=2L이므로 B 20w당 부피가 40L, 즉 B 분자량 x=20w. 답은 5/2w
다른 최단루트
1. 기울기 공식에 의해 a=5
2. 0w지점에선 전체 기체 부피가 y. 계수 비에 의해 5w지점에서 전체 기체 부피는 2y/5
3. 일차함수니깐 내분으로 4w지점의 값을 구하면 됨. y와 2y/5를 4:1 내분하면 (5y+8y)/25=13y/25. 이게 26이니깐 y=50.
4. 완결점에서 부피는 20인걸 알 수 있고, B 3w를 넣었는데 6L증가했으므로 B 20w당 부피가 40L -> 분자량 20w. 답 5/2w

200720
스포방지용 간격
설명 포함 최단풀이
0. 주의할점 : 미리 반응을 어느정도 시킨 상태에서 더 반응시키는 상황임 낚이면 안됨
1. (0~w), (w~2w), (2w~3w)의 변화는 -6, -2, 2. 구간 길이 같으므로 이걸 평균 변화율로 둬도 무방하며, 기울기가 세개가 나왔으므로 앞선 문제와 같은 논리로 완결점은 (w~2w)에 존재함
2. -2는 -6과 2의 중점이므로 기울기 내분 하면 완결점은 1.5w
3. 기울기 비가 완결점 전후 -6:2=-3:1이므로, 기울기 공식을 사용하면 a=5
4. 1.5w에서 전체 기체의 부피는 완결점 이전이나 이후의 기울기를 이용해서 계산하면 12, 계수 비에 의해 시작할 때 부피는 30
5. 21은 30과 12의 중점이므로, 과정 (가)에서 1/2반응지점까지 반응시킨 후 (나)에서 계속 B를 투입했다는 것을 알 수 있음.
6. 1/2반응지점까지 반응시키려면, A의 초기 부피가 30이므로 B는 부피 3 만큼 넣어주면 됨(6개 넣으면 완결점이니깐 절반 반응지점은 3개넣으면 됨). 따라서 n/m=1/10, a랑 곱하면 1/2
요약 : 기울기공식쓰면 a=5, 내분하면 완결점 1.5w, 1.5w일때 부피 12니깐 시작할때 부피 30, 21은 30이랑 12의 중점이므로 (가)에서 1/2반응지점까지 반응시킴, 따라서 m:n=10:1. 끝.
여기까지 포인트 : 일차함수 그래프 유형은 내분을 은근 많이 쓰게 된다. 잘 분석해보자

210920
스포방지용 간격
일단 들어가기에 앞서서 이 문제는 많은 학생(심지어 강사들 마저) 논리적 비약을 하며 풀고있음
다들 첨가한 산 용액의 부피가 V일때 (나)의 몰농도가 (다)보다 작으므로 (나)가 2가를 투입했다~이런 소리를 하는데
너무 당연한 반례 하나를 들면, 만약에 이 시점에서 (나)랑 (다)가 둘 다 산성이면 작은 쪽이 1가를 투입한거임
(나)에서 V일때 염기성이니깐 가능하지 않냐고 물어볼 수 있는데
(다)가 V일때 산성이면 또 모순 만들 수 있음
제대로 된 논증은 (나)와 (다)가 둘다 염기성이다 -> 중화점 이전에 1가 산을 투입하면 이온 수는 안변하는데, 2가 산을 투입하면 개수가 감소한다->따라서 (나)가 2가를 투입했다 이거임.
암튼 최단풀이
0. 염기성 용액에 산성용액 한 종류를 일정하게 투입하면 모든 이온의 몰 농도 합 그래프는 무조건 감소하다가 증가하는 개형을 가진다는 것을 상기하자(만약 산성용액 두 종류를 투입하면 감소하다가 일정하거나, 계속 감소하는 그래프 개형을 가지는 것도 가능함)
1. (나)에서 V와 3V일때 모든 이온의 몰 농도 합이 같으므로, 개형을 떠올리면 V일때 염기, 3V일때 산성이다.
2. (다)에서 V와 2V일때 모든 이온의 몰 농도 합을 비교하면 V일때 더 크므로, V는 확실히 염기이고 2V일때 액성은 알 수 없다(만약 V가 산성이라면 2V일 때 모든 이온의 몰 농도 합은 증가해야함)
3. (나)와 (다)가 V일때 둘 다 염기성이므로, 모든 이온의 몰 농도 합이 더 작은 (나)가 2가 산을 투입한 상황이다
----------------논증파트 끝--------------------
1. (다)에서 투입한 HA가 0ml, Vml일 때 모든 이온의 개수 합이 같아야 하므로 1*10=(V+10)*3/5을 풀면 V=20/3
2. (나)에서 3V(=20)ml을 투입했을때 이온의 양은 1/2 * (20+10)=15mmol. 2가 산과 1가 염기의 혼합이고, 액성은 산성이므로 15mmol의 1/3인 5mmol이 B2-의 양
3. HA와 H2B의 몰농도가 같으므로 (다)의 3V 시점에서 A-의 양도 5mmol
4. 반응 초기에 모든 이온의 양은 10mmol이므로 Na+의 양은 5mmol임. 즉 (다)의 3V시점에서 용액은 중성. 모든 이온의 양은 여전히 10mmol
5. 따라서 10/30=1/3이 답
설명 하나 : 2가 산과 1가 염기의 혼합 상황에서 염기일때, 산성일때 모든 이온의 개수 합 공식은 그냥 외워두자
산을 x개 염기를 y개 넣었다 치면
만약 산성이면 전체 개수는 3x가되고
만약 염기면 전체 개수는 2y-x가 됨
이걸 더 확장한 공식이 있긴 한데 내책에 있음 대충 캡쳐해옴


0 XDK (+0)
유익한 글을 읽었다면 작성자에게 XDK를 선물하세요.
-
실수도 실력임 1
근데 운은 실력이 아니라고 생각함 내가 실전에서 실수로 틀린 건 반성해야하지만 운의...
-
기하 안하시는 이유가 머죠 공부량이든 난이도든 기하가 압도적으로 수월할텐데 표점도...
-
생각해보면 계산실수도 잦고 그냥 풀이 방향성 찾는 거만 잘하는 듯
-
삼수생 조언 0
약대 목표입니다 1. 7월까지 공부하다가 공군입대 후 26 27수능 2. 쌩삼수...
-
생윤 47점인데 진학사랑 메가에선 표점 74라는데 고속에선 66으로 뜨네요…??...
-
미적: 아 미적 왜했지 확통할걸 기하를 해야한다는거임..
-
제 생기부 확인할 수 있나요?
-
배성민T 드리블 0
내년에 배성민쌤 드리블 수강 할 예정인데 겨울방학에 학원에서 하는 실전개념 한 후에...
-
잘자 해줘 4
안하면 나 몬자..
-
그냥 이제 내 소유임 ㅇㅇ
-
졸리 다는거임 0
잘게용
-
수시 쓸 땐 제발 의대 납치 되게해달라고 빌었는데 정작 수능에서 100 96 1...
-
미적30번풀어봄 0
기냥 잘 흘러흘러풀먼 풀리겟네요
-
자기~~
-
피드백 해주세요. 여친한테 선물하고 싶어서
-
미적28벜풀어봄 0
갠적으로뽀인트 1. gx 구하고 x*gx 미분하고 1너으면 답이되므로 g구하고...
-
인생그냥답이없네 0
ㅋㅋ왜살까
-
5월 23일임 노린 거 아님 참고로 커뮤는 오르비만 함
-
삼수,삼반수 1
현역 87478에서 재수 45422 까지 올렸습니다 현역때는 공부를 안했던 것도...
-
성격 존나 더러워짐 이젠 일 안하지만 아직 신경질적인게 남아있는듯
-
질문 받음 7
고졸 무직 걸그룹 마스터 야구 중독자
-
약대.25학번 예정인데 공부량 많음? 지금부터 물1,2 생2,화2 공부해서...
-
당신도 예비 의대생 1일 1의학 문제 (241117) 2
31세 여자가 혈압이 낮다고 병원에 왔다 오른쪽 팔에서 측정한 혈압 측정 결과...
-
200 ㄷㄷ
-
건국대는 경북대가 못비비는거 맞는 것 같은데 저는 동국대 홍익대 공대보다 경북대...
-
발이 그만큼 좋단거임..
-
현역 수능결과 3
미적 85 영어 89 생1 45 수시러인데 현역으로 이정도면 몇타치임?
-
되면 망원경 하나 만들거임 진지하게 가능함?
-
대성패스 3월 1
대성패스 지금 안 사고 3월쯤 사려고 하는데 저 때는 가격 얼만가요?
-
성논 수1 수2가 범위인 걸로 아는데 미적 내용인 매개변수 치환적분 이런거 쓰면 안 되는 거죠??
-
인강신규런칭 0
대성 물리 신규 런칭이 누구일지 궁금한데 보통 언제쯤 나와요??
-
그런 법은 제정되지 안ㄹ앗단거임 실제로 국회갓는데 업엇음
-
공대 갈때 물2/기하/확통 안하고 가면 적응 힘든가요? 기계나 전기전자...
-
순위가 교과쓴 374명중 118등임 여기서 최저 충족률 40퍼라 치면 실제 몇등정도라 생각해야함??
-
교차 상관없어요... 어디 갈 수 있을까요 여대도 상관 X
-
찐따라는거임.. 어차피찐다일거면 존예아싸여고생하고싶다는거임 구냥 히토리쟝되고싶다.....
-
연대 약대, 한양대 약대 점공 11등정도 됨. 최저 둘다 맞춤. 앞에 몇명 정도 최저 미충족일까요
-
왜냐면 사실 생각보다 베이스의 역할이 크기때문임 실제로도 나는 결속밴드에서 최애가...
-
으흐흐 4
오빠가 알려줄게
-
( ՞•ﻌ•՞ )
-
최소한 만점이면 백분위 100은 나오는 선에서 난이도 쉽든 어렵든 뭐든 상관없는거아님?
-
공1 선2
-
대학을잘가게된다면.. 오르비상주하면서 도움을 주고싶구나 공부해보고싶어도...
-
노재능충이라는거임..
-
미방짤로 무엇을 할까
-
슬슬자볼가 0
뻥이라는거임
-
올해 대학와서 얻은 것들도 많은데 이정도면 등가교환인가 하.. 미적 늦게 시작한게 후회되네
-
3000천명 이란 썰도 잇고 머 600명대란 말도 잇던데 1500명- 2000명...
-
올해 간다 간다 간다 그래 ㄴㅐ가 아무리 그래도 7번을 틀릴 리가 없지











































190919 a=5 안쓰는 풀이 하나 얹자면
0,0 5w,x를 이어주면 전 후 기울기가 2:1
13w=26이 나오고, 26이 y와 20을 4:1내분점이라 y=50을 구하는 방법.
그런데 a=5가 뻔히 보이는데 안찾고 푸는게 넌센스긴 하죠 ㅋㅋ
210920 V = 20/3 안구하는 풀이 하나 얹자면
액성 구한 후
V지점에서 이온 수 비가 6:5
중화점에서 이온 수 비가 4:3이니까 1.5V에서 2가 중화 -> 3V에서 1가 중화
1가 염기에 산 용액 첨가, 혼합용액이 산성일때 전체이온수 = 첨가한 산 이온수
따라서 3V지점 이온수비는 3:2
y=1/3
그런데 위랑 마찬가지로 V=20/3이 보이는데 안구한다는게 넌센스라 너무 뒷북스러운 풀이
첫번째껀 처음보네용
두번째껀 알고는 있었는데 까먹고 안 적었네요ㅋㅋ 근데 안구하는게 넌센스긴하죠 풀이시간 비슷하기도 하고

논화!논화!논화!논화!논화!6평 18번같은 순한맛 양적 빨리 푸는 방법이 궁금해요.. 그 문제를 19번보다 더 오래걸린듯

와 너무 유익해요!